유치 치수 줄기세포 배양 상청액을 특수 가공한 99.9% 순수 엑소좀 점적요법
엑소좀이란?
엑소좀은 체내에 존재하는 50~150 나노미터의 아주 작은 지질막으로 둘러싸인 세포체를 말한다.
엑소좀에는 마이크로 RNA, 메신저 RNA, DNA, 단백질 등이 포함되어 있으며, 그 중 마이크로 RNA와 메신저 RNA는 세포와 세포가 서로 연락하고 정보를 주고받는 세포 간의 중요한 커뮤니케이션 도구라는 것이 최근 밝혀졌다.
이러한 엑소좀의 특성을 활용한 치료를 통해 노화 치료를 비롯한 다양한 분야에서 효과를 발휘할 수 있을 것으로 기대되고 있다.
본원의 엑소좀 치료
엑소좀의 잠재력은 매우 크며, 인간의 37조개의 세포에 다양한 형태로 영향을 미쳐 세포의 변화와 일상적인 생명 유지에 큰 역할을 하고 있습니다.
현재 우리는 관련 의료기관에서 유치 치수 줄기세포 유래 엑소좀 치료 및 데이터 분석을 추진하고 있습니다.
퓨어엑소란?
퓨어엑소는 유치 치수 줄기세포에서 추출한 엑소좀만을 99.9%의 순도로 정제하여 만든 것입니다. 배양상청액에서는 체내로 엑소좀을 도입할 때 매우 많은 양을 투여해야 했지만, 퓨어엑소는 약 1/10의 양으로 배양상청액의 약 10배에 달하는 엑소좀을 체내로 투여할수있습니다.
배양 상청액에는 엑소좀 외에도 다양한 성장인자, 사이토카인, 배양액 등이 포함되어 있습니다. 퓨어엑소는 엑소좀만을 분리했기 때문에 사이토카인 폭풍이 일어나지 않고 한 번의 투여로 많은 양의 엑소좀을 투여할 수 있습니다.
SGF 5ml에는 40억 개의 엑소좀이 들어있지만, 퓨어엑소는 1회 투여로 1,000~2,000억 개의 엑소좀을 넣을 수 있습니다.
SGF는 한 번에 5㏄~20~30cc(엑소좀 100억개~500억개)를 투여할 수 있지만 1,000억개 이상은 퓨어엑소가 아니면 넣을 수 없습니다.
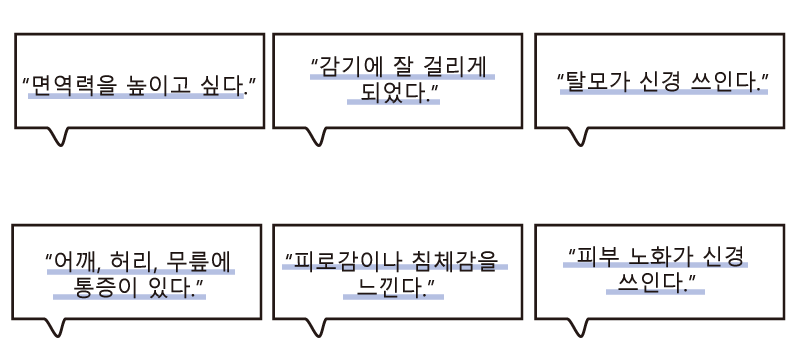
이런 분들에게 추천
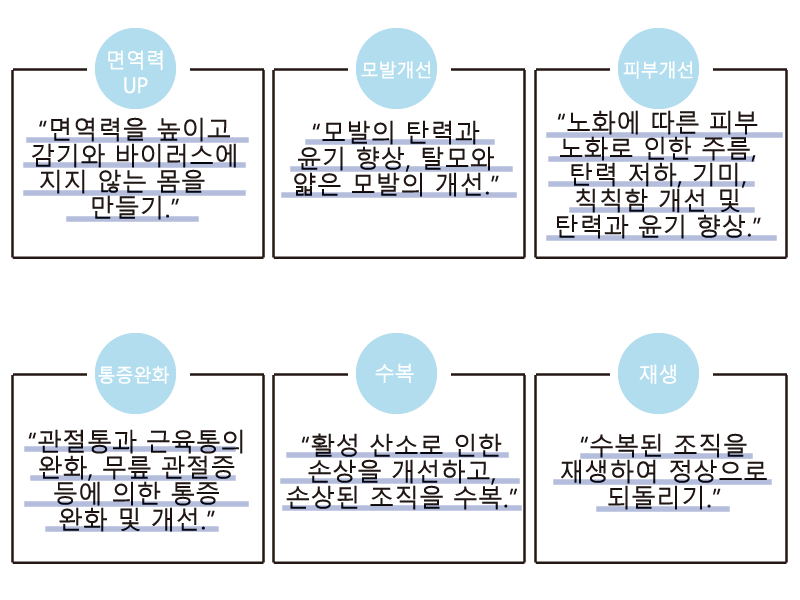
기대되는 효과
가격표
| PURE EXO 100(엑소좀 100억 개) | 220,000엔 |
| PURE EXO 1000(엑소좀 1000억 개) | 1,100,000엔 |
가격은 모두 세금 포함 금액입니다.
본원은 자유진료(공적 의료보험 적용 제외)입니다.
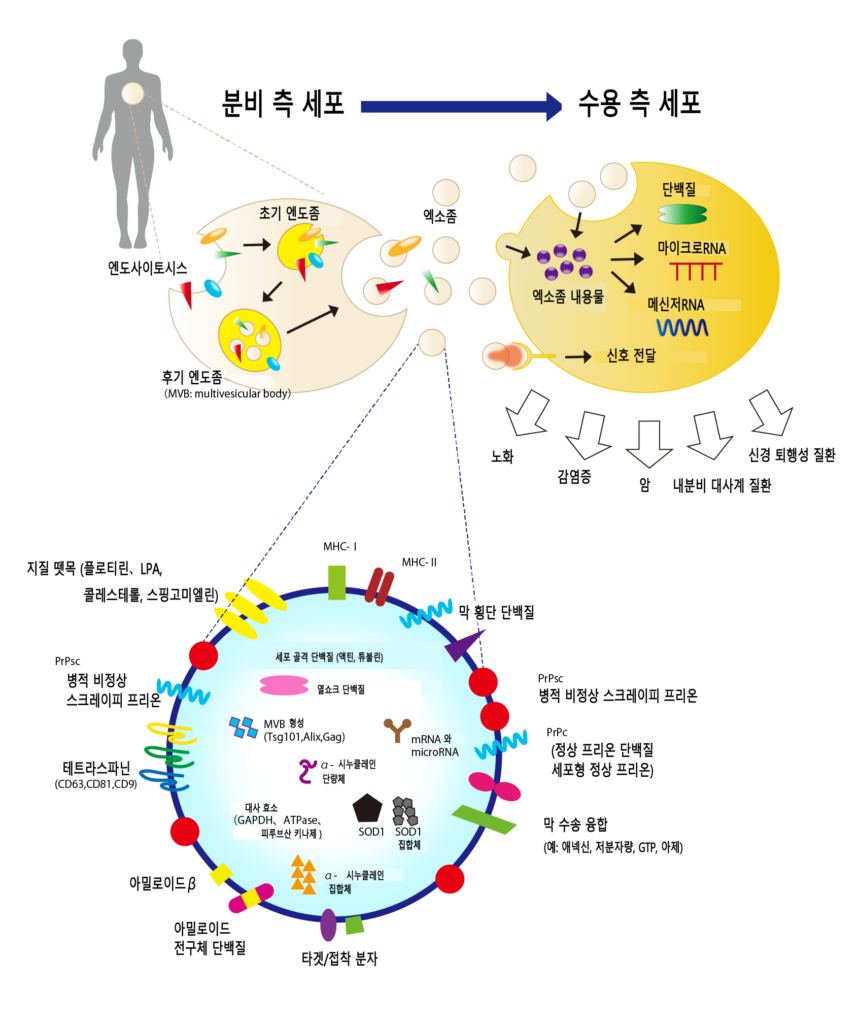
엑소좀의 구조
엑소좀은 엔도사이토시스(endocytosis, 세포가 세포 외 물질을 받아들이는 과정)에 의해 세포 내로 만들어진 엔도솜이 세포 내로 침투하여 만들어진 막소포가 세포 밖으로 방출되어 생성된다. 엑소좀 내부에는 원래 세포의 물질이 포함되어 있으며, 표면에는 테트라스패닌류(CD9, CD63, CD81 등)와 인테그린류 등의 막단백질, 주요 조직적합성유전자복합체(MHC) 분자가, 내부에는 다낭체 형성과 관련된 단백질(Tsg101, Alix), 열 충격 단백질(HSP)이 많이 존재합니다.

엑소좀은 세포 간 정보 전달을 담당하는 메신저
엑소좀은 세포에서 방출되어 혈액의 흐름을 타고 온몸을 돌아다닌다. 이때 엑소좀에 포함된 마이크로RNA와 메신저RNA가 체내 모든 장기에 속한 세포와 소통하며 다양한 행동을 하게 한다. 예를 들어 ‘신진대사를 촉진해라’, ‘혈관을 만들어라’와 같은 것들입니다.
이러한 커뮤니케이션은 ‘장 세포에서 뇌 세포로’, ‘신장 세포에서 장 세포로’ 등 다양한 세포 간에도 이루어지는데, 그 사이에도 정보 전달자인 엑소좀의 존재가 필수적이라고 할수있습니다.
지금까지의 상식으로는 이러한 커뮤니케이션은 모두 뇌를 통해 이뤄진다고 생각했다. 하지만 엑소좀 연구를 통해 그뿐만이 아니라는 사실이 밝혀지고 있다. 예를 들어, 음식을 너무 많이 먹으면 몸은 자연스럽게 신진대사를 높여 이를 소비하려고 하는 것처럼 우리가 평소 건강하게 생활할 수 있는 것은 각 장기가 서로 협력하여 더 나은 상태를 유지하고 있기 때문입니다.
엑소좀을 비롯한 세포들끼리 직접 소통하며 각 장기를 적절히 움직이게 하는 메커니즘이 우리 몸을 정상적으로 작동하게 하고 건강한 상태를 유지하게 하는 것이다.
줄기세포 배양 상청액과 줄기세포 엑소좀의 차이점
“줄기세포 배양 상청액과 엑소좀은 다르다”
줄기세포 배양 상청액은 제법과 품질 관리를 확인하는 것이 중요합니다. 품질은 입자의 총수가 아닌 줄기세포 엑소좀의 순도와 마커(CD9, CD63)를 확인하는 것이 좋습니다. 줄기세포 엑소좀 이외의 입자는 인체에 유해할 가능성도 있습니다.
【일반적인 배양 상청액의 구성 성분 】

【PURE EXO®】
‘PURE EXO®’는 재생의학 인증 의사가 감독하고 수석 배양사가 상주하는 SOLARIA CLINIC LAB에서 배양, 제조하고 있습니다.
간엽줄기세포 엑소좀에 기대할수 있는 것들
지방세포의 혈관신생 촉진 촉진
쥐를 이용한 연구에서 지방줄기세포 엑소좀과 지방줄기세포(처리된 것)와 식염수에 지방세포(조직)를 이용하여 그 정착을 비교한 연구에서는
혈관의 신생과 정착 수준은 식염수만 투여한 경우와 비교하여 지방줄기세포 엑소좀과 지방줄기세포(처리된 것)는 뚜렷한 차이를 보였다. 또한, 엑소좀만 처리한 경우와
지방세포를 비교했을 때, 엑소좀은 지방세포를 사용한 경우와 동등한 수준의 정착을 보였다. 이는 엑소좀의 효과가 줄기세포 이식과 동등한 효과가 있다는 증거라고 할수 있다.
Plast Reconstr Surg. 2019 Nov;144(5):816e-827e. doi: 10.1097/PRS.0000000000006175.
Exosomes Are Comparable to Source Adipose Stem Cells in Fat Graft Retention with Up-Regulating Early Inflammation and Angiogenesis
Bin Chen, Junrong Cai, Yating Wei, Zhaohua Jiang, Haley E Desjardins, Alexandra E Adams, Shengli Li, Huang-Kai Kao, Lifei Guo
간엽줄기세포 엑소좀을 이용한 세포 및 조직의 복구, 재생, 노화 케어에 대하여
아래의 논문을 통해 간엽줄기세포 엑소좀은 세포 및 조직의 복구, 재생, 노화케어에 대한 다양한 연구가 진행되고 있으며, 많은 성과가 발표되고 있습니다,
그 효과에 대해 많은 성과가 발표되고 있습니다.
Expert Opin Biol Ther. 2016;16(4):489-506. doi: 10.1517/14712598.2016.1131976. Epub 2016 Jan 28.
Exosomes for repair, regeneration and rejuvenation Joydeep Basu, John W Ludlow
3. Maguire G. Stem cell therapy without the cells. Commun Integr Biol. 2013;6:e26631. DOI:10.4161/cib.26631.
5. Caplan AI, Correa D. The MSC: an injury drugstore. Cell Stem Cell. 2011;9:11-15.
13. Valadi H, Ekstrom K, Bossios A, et al. Exosome mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biol. 2007;9:654-659. Demonstration of exosome-mediated communication between cells during development
14. Ratajczak J, Miekus K, Kucia M, et al. Embryonic stem cell derived micro-vesicles reprogram hematopoietic pro-genitors: evidence for horizontal transfer of mRNA and protein delivery. Leukemia. 2006;20:847-856.
19. Yanez-Mo M, Siljander PR, Andreu Z, et al. Biological proper-ties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 2015;4. DOI:10.3402/jev.v4.27066.
32. Deregibus MC, Cantaluppi V, Calogero R, et al. Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizon-tal transfer of mRNA. Blood. 2007;110:2440-2448.
40. Teixeira FG, Carvalho MM, Sousa N, et al. Mesenchymal stem cells secretome: a new paradigm for central ner-vous system regeneration. Cell Mol Life Sci. 2013;70:3871-3882.
41. Vishnubhatla I, Corteling R, Stevanato L, et al. The devel-opment of stem cell-derived exosomes as a cell-free regenerative medicine. J Circ Biomark. 2014;3:2. DOI:10.5772/58597.
43. Liang X, Ding Y, Zhang Y, et al. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplant. 2013;9:1045-1059.
- van Koppen A, Joles JA, van Balkom BW, et al. 인간 배아 중간엽 줄기 세포 유래의 순화 배지는 확립 된 만성 신장 질환이있는 쥐의 신장 기능을 구합니다. PLoS ONE.
(?) onescu L, Byrne RN, van Haaften T, et al. 줄기세포 배양 배지는 생쥐의 급성 폐 손상을 개선한다: 줄기세포 파라크린 작용에 대한 생체 내 증거.
Am J Physiol 肺細胞 Mol Physiol。 2012;303:L967–977.
45. Ratajczak MZ, Kucia M, Jadczyk T, et al. Pivotal role of paracrine effects in stem cell therapies in regenerative medicine: can we translate stem cell-secreted paracrine factors and microvesicles into better therapeutic strate-gies. Leukemia. 2012;26:1166-1173.
50. Osugi M, Katagiri W, Yoshimi R, et al. Conditioned media from mesenchymal stem cells enhanced bone regenera-tion in rat calvarial bone defects. Tissue Eng Part A. 2012;18:1479-1489.
51. Maumus M, Jorgensen C, Noel D. Mesenchymal stem cells in regenerative medicine applied to rheumatic dis-eases: role of secretome and exosomes. Biochimie. 2013;95:2229-2234.
52. Toh WS, Foldager CB, Pei M, et al. Advances in mesench-ymal stem cell-based strategies for cartilage repair and regeneration. Stem Cell Reviews and Reports. 2014;10:686-696.
53. Akyurekli C, Le Y, Richardson RB, et al. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles. Stem Cell Rev. 2015;11:150-160. Review of key preclinical studies associated with mesenchymal stem cell (MSC)-sourced exosomes
55. Gatti S, Bruno S, Deregibus MC, et al. Microvesicles derived from human adult mesenchymal stem cells pro-tect against ischaemia reperfusion induced acute and chronic kidney injury. Nephrol Dial Transplant. 2011;26:1474-1483.
56. Wang Y, Zhang L, Li Y, et al. Exosomes/microvesicles from induced pluripotent stem cells deliver cardioprotec-tive miRNAs and prevent cardiomyocyte apoptosis in the ischemic myocardium. Int J Cardiol. 2015;192:61-69.
57. Kilpinen L, Impola U, Sankkila L, et al. Extracellular membrane vesicles from umbilical cord blood derived MSC protect against ischemic acute kidney injury, a feature that is lost after inflammatory conditioning. J Extracell Vesicles. 2013;10:3402.
60. Lamichhane TN, Sokic S, Schardt JS, et al. Emerging roles for extracellular vesicles in tissue engineering and regen-erative medicine. Tissue Eng Part B Rev. 2015;21:45-54. DOI:10.1089/ten.teb.2014.0300.
61. Sahoo S, Klychko E, Thorne T, et al. Exosomes from human CD34+ stem cells mediate their proangiogenic paracrine activity. Circ Res. 2011;109:724-728.
62. Lee C, Mitsialis SA, Aslam M, et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia induced pulmonary hypertension. Circulation. 2012;126:2601-2611.
63. Zhang J, Guan J, Niu X, et al. Exosomes released from human induced pluripotent stem cells derived MSCs facilitate cutaneous wound healing by promoting col-lagen synthesis and angiogenesis. J Trans Med. 2015;13:49. DOI:10.1186/s12967-015-0417-0.
64. Ibrahim AG, Cheng K, Marban E. Exosomes as critical agents of cardiac regeneration triggered by cell therapy. Stem Cell Reports. 2014;2:606-619.
71. Lee HK, Finniss S, Cazacu S, et al. Mesenchymal stem cells deliver exogenous miRNAs to neural cells and induce their differentiation and glutamate transporter expres-sion. Stem Cells Dev. 2014;23:2851-2861.
73. Zhuang X, Xiang X, Grizzle W, et al. Treatment of brain inflammatory diseases by delivering exosome-encapsulated anti-inflammatory drugs from the nasal region to the brain. Mol Ther. 2011;19:1769-1779. DOI:10.1038/mt.2011.164.
74. Xin H, Li Y, Liu Z, et al. Systematic administration of exo-somes released from mesenchymal stromal cells promote functional recovery and neurovascular plasticity after stroke in rats. J Cereb Blood Flow Metab. 2013;33:1711-1715.
75. Zhang Y, Chopp M, Meng Y, et al. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury. J Neurosurg. 2015;122:856-867.
76. Doeppner TR, Herz J, Gorgens A, et al. Extracellular vesi-cles improve post-stroke neuroregeneration and prevent postischemic immunosuppression. Stem Cells Transl Med. 2015;4:1131-1143.
77. Xin H, Li Y, Liu Z, et al. MiR-133b promotes neural plas-ticity and functional recovery after treatment of stroke with multipotent mesenchymal stromal cells in rats via transfer of exosome-enriched extracellular particles. Stem Cells. 2013;31:2737-2746.
78. Bruce A, Ilagan R, Guthrie K, et al. Selected renal cells modulate disease progression in rodent models of chronic kidney disease via NFκB and TGFβ1 pathways. Regen Med. 2015;10:815-839.
79. Fleury A, Martinez MC, Le Lay S. Extracellular vesicles as therapeutic tools in cardiovascular diseases. Front Immunol. 2014;5:370. DOI:10.3389/fimmu.2014.00370.
82. Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes: current knowledge of their composition, biological func-tions, and diagnostic and therapeutic potentials. Biochimica et Biophysica Acta. 2012;1820:940-948.
83. Kordelas L, Rebmann V, Ludwig A-K, et al. 2013. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease. Leukemia. 2014;28:970-973. DOI:10.1038/leu.2014.41.
101. Lee HJ, Lee EG, Kang S, et al. Efficacy of microneedling plus human stem cell conditioned medium for skin reju-venation: a randomized, controlled, blinded split face study. Ann Dermatol. 2014;26:584-591.
102. Harn HJ, Huang MH, Huang CT, et al. Rejuvenation of aged pig facial skin by transplanting allogeneic granulo-cyte colony stimulating factor induced peripheral blood stem cells from a young pig. Cell Transplant. 2013;22: 755-765.
103. Kim WS, Park BS, Park SH, et al. Antiwrinkle effect of adipose-derived stem cell: activation of dermal fibroblast by secretory factors. J Dermatol Sci. 2009;53:96-102.
104. Shim JH, Park JY, Lee MG, et al. Human dermal stem/ progenitor cell-derived conditioned medium ameliorates ultraviolet a induced damage of normal human dermal fibroblasts. PLoS One 2013;e67604. DOI:10.1371/journal. pone.0067604.
105. Chen CC, Murray PJ, Jiang TX, et al. Regenerative hair waves in aging mice and extra-follicular modulators Follistatin, Dkk1 and Sfrp4. J Invest Dermatol. 2014;134:2086-2096.
106. Fukuoka H, Suga H. Hair regeneration treatment using adipose-derived stem cell conditioned medium: follow-up with trichograms. Eplasty. 2015;15:e10.
107. Ahmed MI, Alam M, Emelianov VU, et al. MicroRNA-214 controls skin and hair follicle development by modulat-ing the activity of the Wnt pathway. J Cell Biol. 2014;207:549-567.
108. Zhang GE, Grizzle WE. Exosomes: a novel pathway of local and distant intercellular communication that facil-itates the growth and metastasis of neoplastic lesions. Am J Pathol. 2014;184:28-41.
109. Harris DA, Patel SH, Gucek M, et al. Exosomes released from breast cancer carcinomas stimulate cell movement. PLoS One 2015;e0117495. DOI:10.1371/journal.pone.0117495.
111. Li J, Sherman-Baust CA, Tsai-Turton M, et al. Claudin containing exosomes in the peripheral circulation of women with ovarian cancer. BMC Cancer. 2009;9:244. DOI:10.1186/1471-2407-9-244.
118. Mittelbrunn M, Gutierrez-Vazquez C, Villarroya-Beltri C, et al. Unidirectional transfer of microRNA-loaded exo-somes from T cells to antigen-presenting cells. Nature Commun. 2011;2:282. DOI:10.1038/ncomms1285.
119. www.systembio.com [cited 2015 Apr 11].
120. Basu J, Ludlow JW. MSC sourced exosomes as therapeu-tic agents for wound healing and skin regeneration: from scaled production to functional regenerative out-comes in vitro and in vivo. International Society for Stem Cell Research Annual Meeting; 2015 Jun 24-27; Stockholm.
121. Basu J, Ludlow JW. Developmental engineering the kid-ney: leveraging principles of morphogenesis for renal regeneration. Birth Defects Res C Embryo Today. 2012;96:30-38.
122. Genheimer CW, Ilagan RM, Spencer T, et al. Molecular characterization of the regenerative response induced by intrarenal transplantation of selected renal cells in a rodent model of chronic kidney disease. Cells Tissues Organs. 2012;196:374-384.
123. www.fda.gov/BiologicsBloodVaccines/default.htm [cited2015 Apr 11].
간엽줄기세포(MSC)가 분비하는 엑소좀은 이미 많은 연구자들에 의해 의료 활용 등에 대한 연구가 진행되고 있으며
그 치료효과가 보고되고 있습니다.
간엽줄기세포 유래 엑소좀은 줄기세포 자체와 동등하거나 그 이상의 효과를 나타내는 것으로 논문에서 보고되고 있다.
Expert Opin Biol Ther. 2016;16(4):489-506. doi: 10.1517/14712598.2016.1131976. Epub 2016 Jan 28.
Exosomes for repair, regeneration and rejuvenation Joydeep Basu, John W Ludlow