乳歯歯髄幹細胞培養上清を特殊加工した99.9%純エクソソーム点滴療法
エクソソームとは
エクソソームとは、体内に存在する50~150ナノメーターのとても小さな脂質膜に包まれた胞体のことを指します。
エクソソームにはマイクロRNA、メッセンジャーRNA、DNA、タンパク等が含まれており、中でもマイクロRNA、メッセンジャーRNAは細胞同士が連絡し合い、情報を受け渡す細胞間の重要なコミュニケーションツールであることが近年判明されました。
このようなエクソソームの性質を活用した治療を行うことで、エイジングケアを始めとした様々な分野で効果が発揮されると考えられています。
当院におけるエクソソーム療法
エクソソームの可能性は大きく、人間の37兆個の細胞に様々な形で影響をあたえ細胞の変化と毎日の生命の維持に大きな役割を果たしています。
現在私たちは関連医療施設において乳歯歯髄幹細胞由来のエクソソーム治療やデータの解析を推進しています。
ピュアエクソとは
ピュアエクソとは乳歯歯髄幹細胞から抽出したエクソソームだけを99.9%の純度で精製したものです。培養上清液では体内にエクソソームを取り入れる際に非常に多くの量を投与する必要がありましたが、ピュアエクソはおよそ1/10の量で培養上清液のおよそ10倍量のエクソソームを体内に投与することが可能となります。
培養上清にはエクソソームの他に、様々な成長因子やサイトカイン、培養液が含まれています。ピュアエクソはエクソソームだけを単離した為、サイトカインストームが起きずに一回の投与で大量のエクソソームが打てます。
SGF5mlには、エクソソームが40億個入っていますが、ピュアエクソは1回の投与でエクソソーム1,000-2,000億個入れることが可能です。
SGFでは、1度に5㏄~20・30cc(エクソソーム100億個~500億個)を投与することが可能ですが1,000億個以上はピュアエクソでなければ入れることができません。
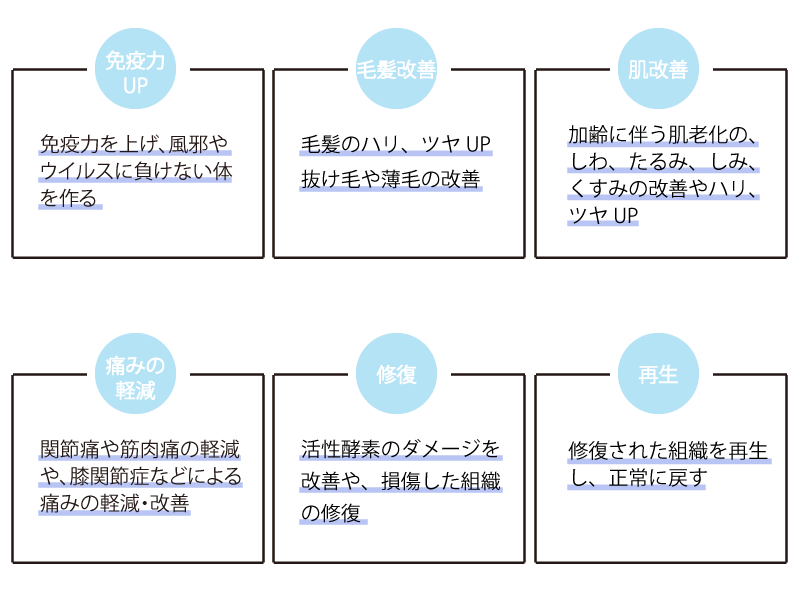
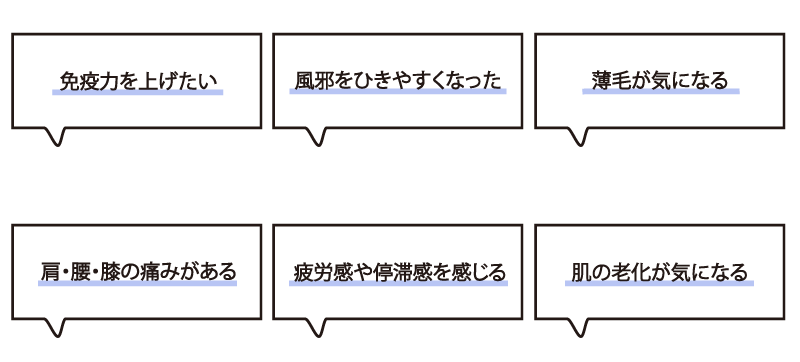
こんな方におすすめ
期待される効果
料金表
| PURE EXO 100(エクソソーム100億個) | 165,000円 |
| PURE EXO 1000(エクソソーム1000億個) | 1,100,000円 |
※価格はすべて税込み金額となります。
当院は自由診療(公的医療保険適用外)です。
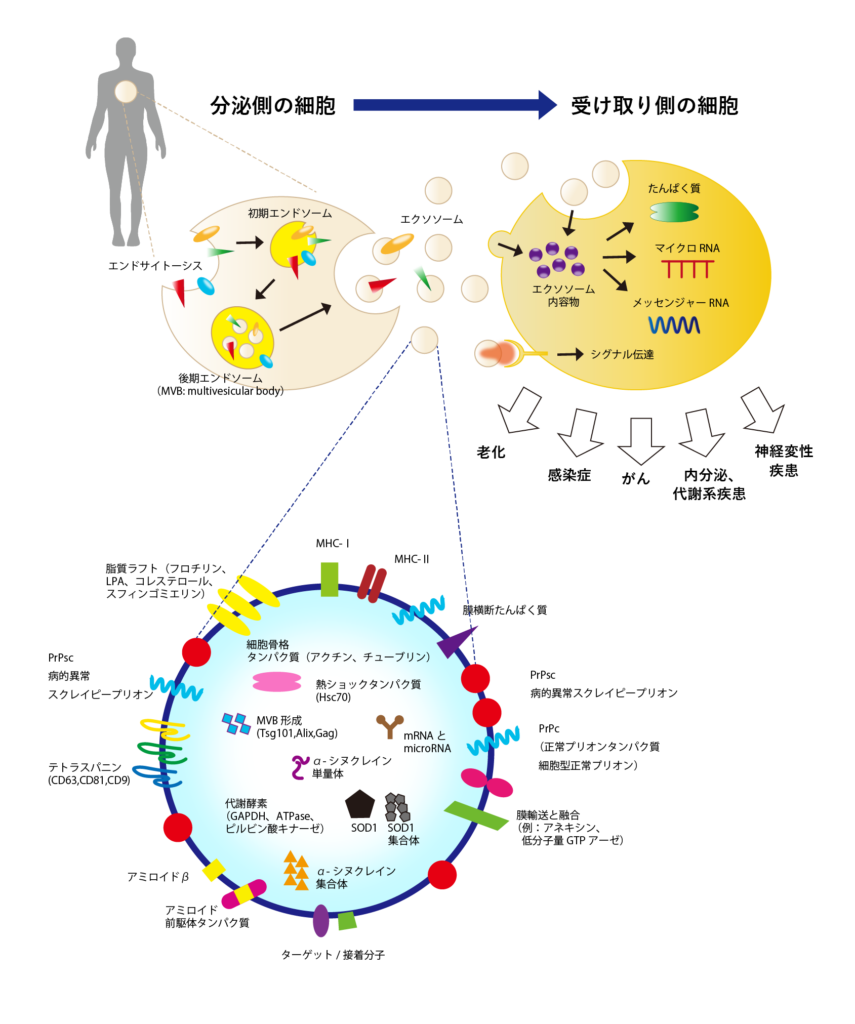
エクソソームの構造
エクソソームは、エンドサイトーシス(細胞が細胞外の物質を取り込むしくみ)により細胞内にできたエンドソームが陥入することで作られた膜小胞が、細胞外に放出されることによって産生されます。エクソソームの内部には元の細胞の物質が含まれ、表面にはテトラスパニン類(CD9、CD63、CD81など)やインテグリン類などの膜タンパク質、主要組織適合遺伝子複合体(MHC)分子が、また内部には多胞体形成に関連するタンパク質(Tsg101、Alix)、熱ショックタンパク質(HSP)が多く存在しています。

エクソソームは細胞同士の情報伝達を行うメッセンジャー
エクソソームは細胞から放出され、血液の流れにのって全身を巡ります。その際に、エクソソームに含まれるマイクロRNAやメッセンジャーRNAが体内のあらゆる臓器に属する細胞とコミュニケーションを取り、さまざまな行動を起こさせます。たとえば、 「代謝を促進せよ」 「血管をつくれ」 というようなことです。
このようなコミュニケーションは、「腸の細胞から脳の細胞へ」 「腎臓の細胞から腸の細胞へ」 といったように様々な細胞間でも行われますが、その間にも情報のメッセンジャーであるエクソソームの存在が必要不可欠と言えます。
これまでの常識では、こうしたコミュニケーションはすべて脳を介して行われていると考えられていました。しかし、エクソソームの研究を通してそれだけではないということが分かってきたのです。例えば、食べ物をたくさん食べすぎると、体は自然と代謝を高めてこれを消費しようとするように、私たちが、普段健康に生活できているのは、それぞれの臓器が互いに連携してよりよい状態を保っているからです。
エクソソームを始めとした組胞同士が直接コミュニケーションを取り、それぞれの臓器を適切に動かしているという仕組みが、私たちの体が正常に機能させ、健康な状態を保っているのです。
幹細胞培養上清液と幹細胞エクソソームの違い
“幹細胞培養上清液とエクソソームは違います”
幹細胞培養上清液は、製法や品質管理を確認することが大切です。 品質は、粒子の総数でなく、幹細胞エクソソームの純度やマーカー(CD9,CD63)を確認することをお勧めします。 幹細胞エクソソーム以外の粒子は、からだに有害な可能性もあります。
【一般的な培養上清液の構成成分 】

【PURE EXO®】
「PURE EXO®」は再生医療認定医が監督し、上級培養士が常駐している、SOLARIA CLINIC LABで培養、製造しています。

間葉系幹細胞エクソソームに期待できること
脂肪細胞の血管新生促進の促進
マウスを用いた研究において脂肪幹細胞エクソソームと、脂肪幹細胞(処理されたもの)と生理食塩水に脂肪細胞(組織)を用いてその定着を比較した研究では
血管の新生と定着のレベルは生理食塩水だけの場合と比べ脂肪幹細胞エクソソームと脂肪幹細胞(処理されたもの)は明らかな差があった。また、エクソソームだけの場合と
脂肪細胞を比較した場合、エクソソームは脂肪細胞を用いた場合と同等の定着であった。これはエクソソームの効果が幹細胞移植と同等の効果があるという証左といえます。
Plast Reconstr Surg. 2019 Nov;144(5):816e-827e. doi: 10.1097/PRS.0000000000006175.
Exosomes Are Comparable to Source Adipose Stem Cells in Fat Graft Retention with Up-Regulating Early Inflammation and Angiogenesis
Bin Chen, Junrong Cai, Yating Wei, Zhaohua Jiang, Haley E Desjardins, Alexandra E Adams, Shengli Li, Huang-Kai Kao, Lifei Guo
間葉系幹細胞エクソソームによる細胞や組織の修復、再生、エイジングケアについて
下記のにおける論文により間葉系幹細胞エクソソームには、細胞や組織の修復、再生、エイジングケアについて様々な研究されており、
その効果について多く成果が発表されています。
Expert Opin Biol Ther. 2016;16(4):489-506. doi: 10.1517/14712598.2016.1131976. Epub 2016 Jan 28.
Exosomes for repair, regeneration and rejuvenation Joydeep Basu, John W Ludlow
3. Maguire G. Stem cell therapy without the cells. Commun Integr Biol. 2013;6:e26631. DOI:10.4161/cib.26631.
5. Caplan AI, Correa D. The MSC: an injury drugstore. Cell Stem Cell. 2011;9:11-15.
13. Valadi H, Ekstrom K, Bossios A, et al. Exosome mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biol. 2007;9:654-659. Demonstration of exosome-mediated communication between cells during development
14. Ratajczak J, Miekus K, Kucia M, et al. Embryonic stem cell derived micro-vesicles reprogram hematopoietic pro-genitors: evidence for horizontal transfer of mRNA and protein delivery. Leukemia. 2006;20:847-856.
19. Yanez-Mo M, Siljander PR, Andreu Z, et al. Biological proper-ties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 2015;4. DOI:10.3402/jev.v4.27066.
32. Deregibus MC, Cantaluppi V, Calogero R, et al. Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizon-tal transfer of mRNA. Blood. 2007;110:2440-2448.
40. Teixeira FG, Carvalho MM, Sousa N, et al. Mesenchymal stem cells secretome: a new paradigm for central ner-vous system regeneration. Cell Mol Life Sci. 2013;70:3871-3882.
41. Vishnubhatla I, Corteling R, Stevanato L, et al. The devel-opment of stem cell-derived exosomes as a cell-free regenerative medicine. J Circ Biomark. 2014;3:2. DOI:10.5772/58597.
43. Liang X, Ding Y, Zhang Y, et al. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplant. 2013;9:1045-1059.
44. van Koppen A, Joles JA, van Balkom BW, et al.ヒト胚性間葉系幹細胞由来の馴化培地は、確立された慢性腎臓病のラットの腎機能を救います。 PLoS ONE。
(?)onescu L、Byrne RN、van Haaften T、他。幹細胞馴化培地は、マウスの急性肺損傷を改善します: 幹細胞パラクリン作用の in vivo 証拠。
Am J Physiol 肺細胞 Mol Physiol。 2012;303:L967–977.
45. Ratajczak MZ, Kucia M, Jadczyk T, et al. Pivotal role of paracrine effects in stem cell therapies in regenerative medicine: can we translate stem cell-secreted paracrine factors and microvesicles into better therapeutic strate-gies. Leukemia. 2012;26:1166-1173.
50. Osugi M, Katagiri W, Yoshimi R, et al. Conditioned media from mesenchymal stem cells enhanced bone regenera-tion in rat calvarial bone defects. Tissue Eng Part A. 2012;18:1479-1489.
51. Maumus M, Jorgensen C, Noel D. Mesenchymal stem cells in regenerative medicine applied to rheumatic dis-eases: role of secretome and exosomes. Biochimie. 2013;95:2229-2234.
52. Toh WS, Foldager CB, Pei M, et al. Advances in mesench-ymal stem cell-based strategies for cartilage repair and regeneration. Stem Cell Reviews and Reports. 2014;10:686-696.
53. Akyurekli C, Le Y, Richardson RB, et al. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles. Stem Cell Rev. 2015;11:150-160. Review of key preclinical studies associated with mesenchymal stem cell (MSC)-sourced exosomes
55. Gatti S, Bruno S, Deregibus MC, et al. Microvesicles derived from human adult mesenchymal stem cells pro-tect against ischaemia reperfusion induced acute and chronic kidney injury. Nephrol Dial Transplant. 2011;26:1474-1483.
56. Wang Y, Zhang L, Li Y, et al. Exosomes/microvesicles from induced pluripotent stem cells deliver cardioprotec-tive miRNAs and prevent cardiomyocyte apoptosis in the ischemic myocardium. Int J Cardiol. 2015;192:61-69.
57. Kilpinen L, Impola U, Sankkila L, et al. Extracellular membrane vesicles from umbilical cord blood derived MSC protect against ischemic acute kidney injury, a feature that is lost after inflammatory conditioning. J Extracell Vesicles. 2013;10:3402.
60. Lamichhane TN, Sokic S, Schardt JS, et al. Emerging roles for extracellular vesicles in tissue engineering and regen-erative medicine. Tissue Eng Part B Rev. 2015;21:45-54. DOI:10.1089/ten.teb.2014.0300.
61. Sahoo S, Klychko E, Thorne T, et al. Exosomes from human CD34+ stem cells mediate their proangiogenic paracrine activity. Circ Res. 2011;109:724-728.
62. Lee C, Mitsialis SA, Aslam M, et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia induced pulmonary hypertension. Circulation. 2012;126:2601-2611.
63. Zhang J, Guan J, Niu X, et al. Exosomes released from human induced pluripotent stem cells derived MSCs facilitate cutaneous wound healing by promoting col-lagen synthesis and angiogenesis. J Trans Med. 2015;13:49. DOI:10.1186/s12967-015-0417-0.
64. Ibrahim AG, Cheng K, Marban E. Exosomes as critical agents of cardiac regeneration triggered by cell therapy. Stem Cell Reports. 2014;2:606-619.
71. Lee HK, Finniss S, Cazacu S, et al. Mesenchymal stem cells deliver exogenous miRNAs to neural cells and induce their differentiation and glutamate transporter expres-sion. Stem Cells Dev. 2014;23:2851-2861.
73. Zhuang X, Xiang X, Grizzle W, et al. Treatment of brain inflammatory diseases by delivering exosome-encapsulated anti-inflammatory drugs from the nasal region to the brain. Mol Ther. 2011;19:1769-1779. DOI:10.1038/mt.2011.164.
74. Xin H, Li Y, Liu Z, et al. Systematic administration of exo-somes released from mesenchymal stromal cells promote functional recovery and neurovascular plasticity after stroke in rats. J Cereb Blood Flow Metab. 2013;33:1711-1715.
75. Zhang Y, Chopp M, Meng Y, et al. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury. J Neurosurg. 2015;122:856-867.
76. Doeppner TR, Herz J, Gorgens A, et al. Extracellular vesi-cles improve post-stroke neuroregeneration and prevent postischemic immunosuppression. Stem Cells Transl Med. 2015;4:1131-1143.
77. Xin H, Li Y, Liu Z, et al. MiR-133b promotes neural plas-ticity and functional recovery after treatment of stroke with multipotent mesenchymal stromal cells in rats via transfer of exosome-enriched extracellular particles. Stem Cells. 2013;31:2737-2746.
78. Bruce A, Ilagan R, Guthrie K, et al. Selected renal cells modulate disease progression in rodent models of chronic kidney disease via NFκB and TGFβ1 pathways. Regen Med. 2015;10:815-839.
79. Fleury A, Martinez MC, Le Lay S. Extracellular vesicles as therapeutic tools in cardiovascular diseases. Front Immunol. 2014;5:370. DOI:10.3389/fimmu.2014.00370.
82. Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes: current knowledge of their composition, biological func-tions, and diagnostic and therapeutic potentials. Biochimica et Biophysica Acta. 2012;1820:940-948.
83. Kordelas L, Rebmann V, Ludwig A-K, et al. 2013. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease. Leukemia. 2014;28:970-973. DOI:10.1038/leu.2014.41.
101. Lee HJ, Lee EG, Kang S, et al. Efficacy of microneedling plus human stem cell conditioned medium for skin reju-venation: a randomized, controlled, blinded split face study. Ann Dermatol. 2014;26:584-591.
102. Harn HJ, Huang MH, Huang CT, et al. Rejuvenation of aged pig facial skin by transplanting allogeneic granulo-cyte colony stimulating factor induced peripheral blood stem cells from a young pig. Cell Transplant. 2013;22: 755-765.
103. Kim WS, Park BS, Park SH, et al. Antiwrinkle effect of adipose-derived stem cell: activation of dermal fibroblast by secretory factors. J Dermatol Sci. 2009;53:96-102.
104. Shim JH, Park JY, Lee MG, et al. Human dermal stem/ progenitor cell-derived conditioned medium ameliorates ultraviolet a induced damage of normal human dermal fibroblasts. PLoS One 2013;e67604. DOI:10.1371/journal. pone.0067604.
105. Chen CC, Murray PJ, Jiang TX, et al. Regenerative hair waves in aging mice and extra-follicular modulators Follistatin, Dkk1 and Sfrp4. J Invest Dermatol. 2014;134:2086-2096.
106. Fukuoka H, Suga H. Hair regeneration treatment using adipose-derived stem cell conditioned medium: follow-up with trichograms. Eplasty. 2015;15:e10.
107. Ahmed MI, Alam M, Emelianov VU, et al. MicroRNA-214 controls skin and hair follicle development by modulat-ing the activity of the Wnt pathway. J Cell Biol. 2014;207:549-567.
108. Zhang GE, Grizzle WE. Exosomes: a novel pathway of local and distant intercellular communication that facil-itates the growth and metastasis of neoplastic lesions. Am J Pathol. 2014;184:28-41.
109. Harris DA, Patel SH, Gucek M, et al. Exosomes released from breast cancer carcinomas stimulate cell movement. PLoS One 2015;e0117495. DOI:10.1371/journal.pone.0117495.
111. Li J, Sherman-Baust CA, Tsai-Turton M, et al. Claudin containing exosomes in the peripheral circulation of women with ovarian cancer. BMC Cancer. 2009;9:244. DOI:10.1186/1471-2407-9-244.
118. Mittelbrunn M, Gutierrez-Vazquez C, Villarroya-Beltri C, et al. Unidirectional transfer of microRNA-loaded exo-somes from T cells to antigen-presenting cells. Nature Commun. 2011;2:282. DOI:10.1038/ncomms1285.
119. www.systembio.com [cited 2015 Apr 11].
120. Basu J, Ludlow JW. MSC sourced exosomes as therapeu-tic agents for wound healing and skin regeneration: from scaled production to functional regenerative out-comes in vitro and in vivo. International Society for Stem Cell Research Annual Meeting; 2015 Jun 24-27; Stockholm.
121. Basu J, Ludlow JW. Developmental engineering the kid-ney: leveraging principles of morphogenesis for renal regeneration. Birth Defects Res C Embryo Today. 2012;96:30-38.
122. Genheimer CW, Ilagan RM, Spencer T, et al. Molecular characterization of the regenerative response induced by intrarenal transplantation of selected renal cells in a rodent model of chronic kidney disease. Cells Tissues Organs. 2012;196:374-384.
123. www.fda.gov/BiologicsBloodVaccines/default.htm [cited2015 Apr 11].
間葉系幹細胞(MSC)が分泌するエクソソームはすでに多くの研究者が医療活用等について研究を行っており
その治療効果が報告されています。
間葉系幹細胞由来のエクソソームは、幹細胞そのものと同等、またはそれ以上の効果を示すことが論文で報告されています。
Expert Opin Biol Ther. 2016;16(4):489-506. doi: 10.1517/14712598.2016.1131976. Epub 2016 Jan 28.
Exosomes for repair, regeneration and rejuvenation Joydeep Basu, John W Ludlow