第4のがん免疫治療法NKT細胞標的治療
AlphaGalactosylceramide 刺激自己樹状細胞を用いた NKT 細胞標的治療RIKNKT ® の説明
この治療は、「再生医療等の安全の確保等に関する法律成 25 年法律 85 号 」「厚生労働省令 140 号」に定められた審査業務等に基づき、 日本薬事法務学会認定再生医療等委員会 で審議され承認されたもので、厚生労働大臣に提供計画を提出し、受理されています。
再生医療等の名称:Alpha Galactosylceramide 刺激自己樹状細胞を用いた NKT 細胞標的治療 RIKNKT ®
再生医療等を提供する医療機関:ソラリアクリニック東京
施設管理者:古賀祥嗣
実施責任者及び再生医療等を行う医師:古賀祥嗣
- NKT細胞標的治療の内容
1) 免疫細胞療法とは
現在のがん標準治療は、手術、抗がん剤、放射線の3つからなっています。しかし、これら標準治療でも副作用や体力などの問題で治療ができない場合、あるいは転移や再発した場合には治療はより難しくなります。そこで、がんを攻撃する免疫細胞をがん治療に応用しようとする試みが30年以上前から始まり、免疫学の急激な進歩とともに新しいがん免疫療法の臨床試験が世界中で行われるようになりました。
2) 免疫細胞療法の種類
がん免疫療法には、活性化αβまたはγδTリンパ球、がんペプチドワクチン、樹状細胞ワクチン、NK(ナチュラルキラー)細胞、NKT(ナチュラルキラーティー)細胞のほか、遺伝子を改変した免疫細胞を使ったものもあります。これらの中には、すでに承認されているもの、研究中、治験中のもの、また民間医療機関で自費診療として行われているものがあります。
3) NKT細胞標的治療(RIKNKT®)とは
生体を防御する免疫には、『自然免疫』と『獲得免疫』があります。『自然免疫』はさまざまな抗原(侵入してきた病原体や異常になった自己の細胞)を感知し、それを排除する初期防御を担い、『獲得免疫』では、抗原を特異的に見分け、それを記憶することで、記憶した特定の抗原に対して効果的にかつ強力に排除する仕組みのことです。免疫担当細胞は、前者が主にNK細胞で、後者がT細胞です。免疫が効果的に働くには両者の連携が欠かせません。NKT細胞はNK細胞とT細胞の特徴を併せ持つ性質があると考えられたことからこの名前が得られましたが実際には『自然免疫』と『獲得免疫』の両方の細胞群を同時に活性化し、増殖させる働きを持つ非常に重要な働きをすることが分かりました。NKT細胞標的治療(RIKNKT®)では、患者様の血液中にある『単球』を採取し樹状細胞へ分化させ、樹状細胞に『GMP基準準拠アルファーガラクトシルセラミド』をパルスして樹状細胞表面にNKT細胞が認識する目印を付けます。そして、この樹状細胞を体内に戻したときにNKT細胞と反応して激しく活性化したNKT細胞自体にがん細胞に対する傷害能力がありますが、加えて活性化されたNKT細胞は、自ら産生するサイトカインの刺激によって、NK細胞及びT細胞を活性化し、がん細胞に対して強力な抗腫瘍効果を発揮します。この方法は理化学研究所及び千葉大学で研究が進められ、臨床試験が行われております。また、当クリニックで用いる『GMP基準準拠アルファーガラクトシルセラミド』は安全基準で製造されたもの(株式会社理研免疫再生医学が合成方法を発明し、製造委託企業との間で独占供給契約のもと、同社以外の提供元はありません)を使用しております。
※GMP基準とは:医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」という法令があります。医薬品の製造をする者が守るべき内容を定めたものです。この「医薬品及び医薬部外品の製造管理及び品質管理の基準」を指して「GMP(Good Manufacturing Practice)」と略称しています。
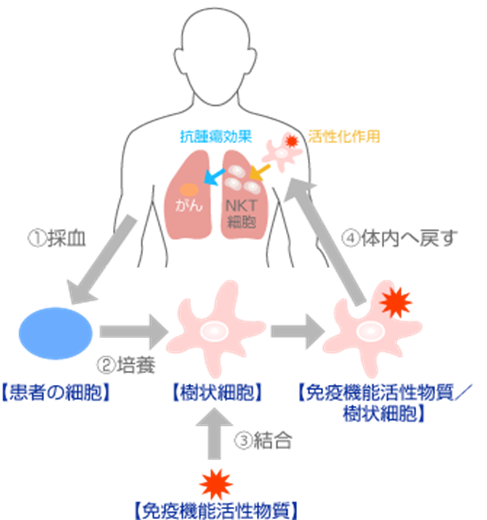
参考:理化学研究所 統合生命医科学研究センター
4) 適応疾患
悪性腫瘍及び医師の判断により免疫機能改善を必要とする者
5) 適格性基準
① 性別:問わない
② 年齢:16歳以上
③ ECOGパフォーマンスステータス:0~3の範囲内であること
④ 同意:
i. 「『Alpha-Galactosylceramide刺激自己樹状細胞を用いたNKT細胞標的治療(RIKNKT®)』の説明と同意書」記載の内容に同意を得ていること
ii. 「研究使用へのお願いと同意書」に記載の内容に同意を得ていること
⑤ 除外対象・疾患等:既往歴、診察、検査等により判断する
i. Tリンパ球型またはNK細胞型悪性リンパ腫患者、白血病患者のうち、同治
療法を受けることに同意しない者
ii. 重度の自己免疫性疾患(乾癬など)で医師が適用除外と判断した者
iii. 活動性気管支喘息
iv. 細菌感染症(発熱など症状、白血球増多より診断)
v. 骨髄移植、臓器移植の既往がある者
vi. 妊娠あるいは妊娠の可能性のある女性及び授乳期の女性
vii. HIV、HTLV-1などのウイルス感染症のキャリア、梅毒感染者あるいは梅毒
の感染が疑われる者
viii. 重篤な心疾患、肺疾患、肝疾患、感染症などの合併症、及び肝機能、腎機能、低栄養状態を医師が総合的に勘案し不適当と判断する疾患及び病状・病態
不適当とする具体的な数値については以下を参考とする。
白血球数 10,000/uL以上
ヘモグロビン 9.0g/dL未満
血小板数 100,000/mL未満
血圧 収縮期血圧200mmHg以上あるいは80mmHg以下
SpO2(room air) 94%未満
6) 採血から細胞投与までの手順
① 問診・診察・感染症等の検査を行います。感染症等の検査結果は患者様本人及び患者様が指定した方のみに伝えます。エイズウイルス、成人T細胞白血病ウイルス、梅毒検査が陽性の場合は、感染症の悪化の可能性や、感染症の治療優先のためNKT細胞標的治療を受けられません。
検査内容
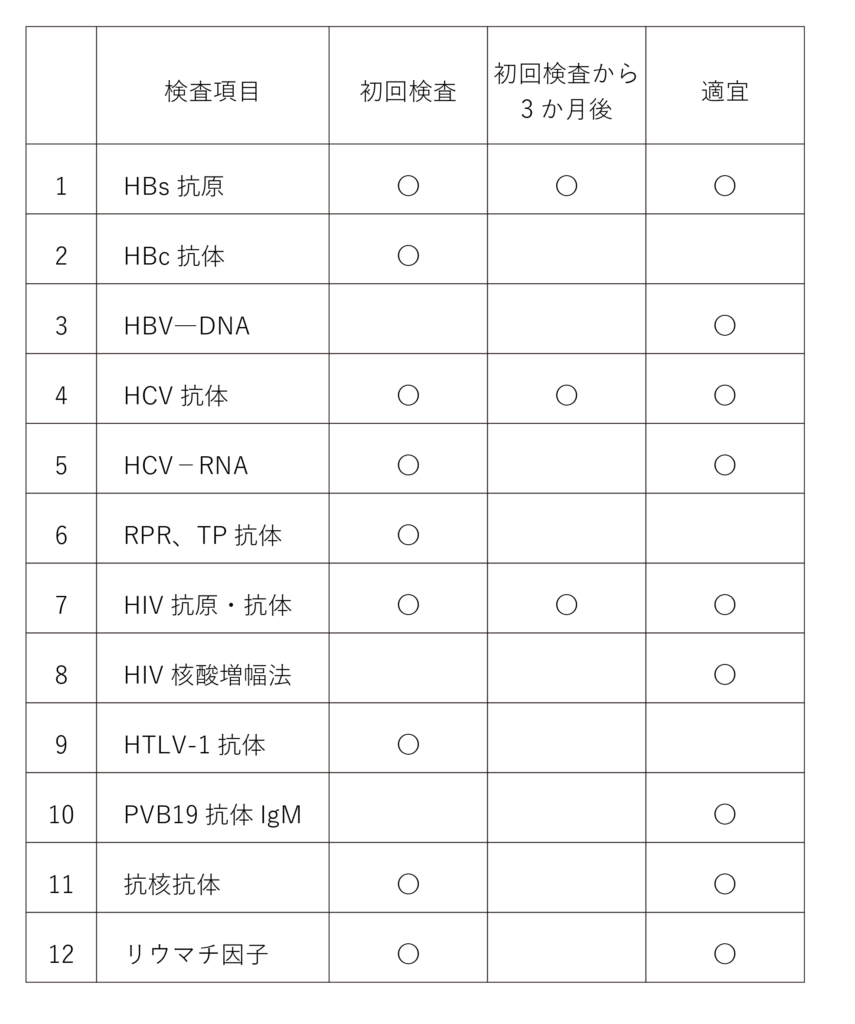
初回検査は細胞治療を受けるために必要な事前検査です。初回検査から3か月後の検査は、ウイルス感染直後にウイルスが検出されない「ウインドウ」期間に対応するために行う検査であり、可能な限り3か月後の検査もお受けください。また、適宜行う検査は、輸血後など臨床的に必要と考えられるときに行います。
② ①の結果、治療できると判断された場合、血液から単核球を大量に採取するために成分採血(アフェレーシス)という採取方法を行います。樹状細胞のもとになる単球はリンパ球の1/1000に満たないためアフェレーシス法が必要となります。これはアフェレーシス専用の医療機器を使い、体外を循環させる血液量は4000mL程度を目安に単核球を採取し、採血時間は通常2~3時間かけて実施します。具体的には、腕や鼠径部の静脈に注射針を刺しこれを機械に連結して遠心分離することにより単核球を選別してそのほかの血液は血管に戻します。まれに、患者様の血管の状態を確認して、静脈より成分採血ができないと医師が判断をした場合には、動脈より成分採血を実施することがあります。
③ 血液から採取した単球は、樹状細胞に分化させた後に、充分な時間培養することで成熟させた後で、『GMP基準準拠アルファーガラクトシルセラミド』で刺激します。細胞培養は、バイオアクセル株式会社京大桂ベンチャープラザ細胞培養加工施設に委託して行います。
④ 培養終了後、『GMP基準準拠アルファーガラクトシルセラミド』で刺激した樹状細胞を凍結保存します。
⑤ 凍結保存した樹状細胞の安全性を確認するために感染検査(無菌試験等)を1週間かけて試験します。
⑥ ⑤で安全性が確認された後に、凍結保存していた『GMP基準準拠アルファーガラクトシルセラミド』で刺激した樹状細胞をマイナス20°以下の環境下で当院に転送し、当院ではマイナス80°以下で保管します。出者様が来院されましたら、原則、2週毎に4回にわけて投与とします。ただし、医師が適切と判断し患者様が同意した場合はこの限りではありません。投与は、50mL程度の生理食塩水と混注して点滴静脈注射により行われます。
7) 投与細胞の安全性確保
樹状細胞の培養は、バイオアクセル株式会社京大桂ベンチャープラザ細胞培養加工施設で高度な技術管理のもとに実施します。しかし、培養細胞が細菌などに汚染されていないことを投与前に幾重にも確認しておくことが極めて重要です。細胞投与の安全性を確保するために、培養した細胞(『GMP基準準拠アルファーガラクトシルセラミド』により刺激された樹状細胞)を投与前に無菌試験、マイコプラズマ否定試験、エンドトキシン試験等を実施して安全性を確認します。
8) 培養した樹状細胞数が規格値に達しない場合
樹状細胞の培養は、クリーンルーム内で高度な技術管理のもとに実施しますが、樹状細胞の分離、回収、調整は採取した血液の状態に依存するため、得られる樹状細胞の性状や数は一定ではありません。(樹状細胞が十分に確保できない、試験に合格できない等の場合には日程通りに治療が行えません。)
9) 血液・培養細胞の試料提供と保管
治療に使用する血液、培養細胞は、万が一感染症などが起こったときの参考試料として、そのごく一部を一定期間保管することが義務付けられています。患者様の血液及び培養細胞の一部を提供していただきます。保管される試料の量は治療に必要とされる量のごく一部(約1mL)であり、治療に影響を与える量ではありません。
提供いただいた試料はバイオアクセル株式会社京大桂ベンチャープラザ細胞培養加工施設にて1年間保管・管理し、治療中または治療後に疾病等の発生があった場合に、その原因究明に使用されます。疾病等発生の原因究明のための保管は凍結した状態で保管します。使用しない場合は保管開始から1年後に適切な方法で廃棄いたします。提供いただいた試料は開示した目的にのみ使用され、他人の治療等に使用されることはありません。
- 予期される効果と副作用
1) 効果について
NKT細胞標的治療はすでに大学等の研究機関で臨床試験が行われ、進行性肺がんや頭頸部がんに十分な効果を示唆する結果が発表されています。しかし、治療によって得られる効果は、患者様の病状や病態、血液状態などによって個人差が生じますのであらかじめご了承ください。当クリニックでは、患者様が現在治療中(受診中)の病院にご協力をお願いし、効果判定に必要な検査データを収集し検証したいと考えています。今後も引き続き信頼のできる治療が提供できるように、患者様ごとに最適な投与法を行います。NKT細胞標的治療は、理論的には全てのがん患者に行うことが可能な治療方法ですが、全てのがん患者で投与の結果が検証された治療法ではありません。
参考として、医師主導型治験として行われた、肺がんと頭頸部がんに対するNKT細胞標的治療の結果を提示します。
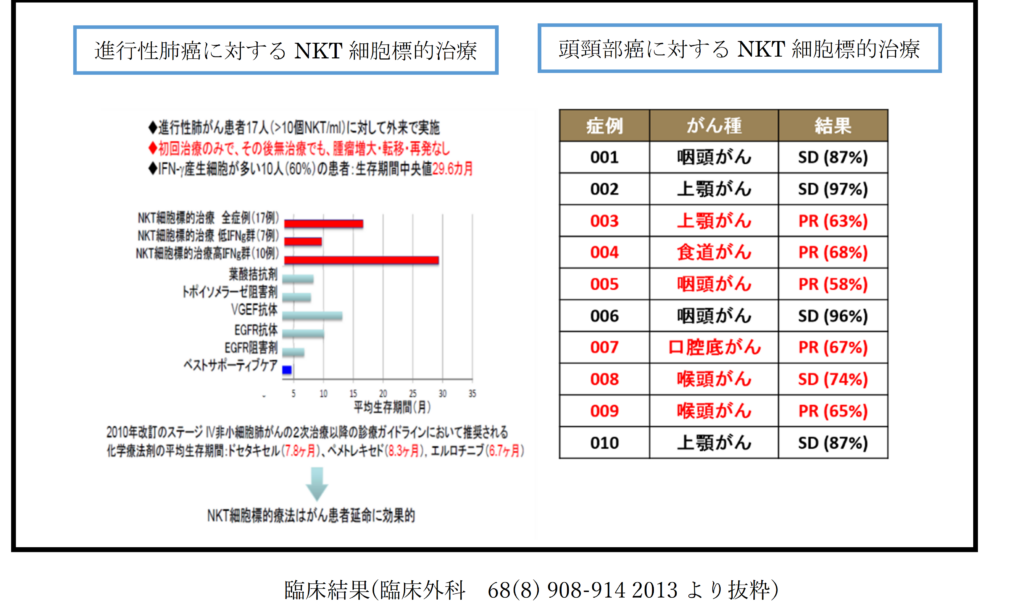
2) 治療の副作用について
『GMP基準準拠アルファーガラクトシルセラミド』で刺激した樹状細胞を投与した後に軽い発熱や倦怠感が起こることがありますが、多くの場合は38℃程度でかつ2日以内に解熱するもので軽微なものです。また、ごく稀にアレルギー反応と思われる症状の出現をみることもあります。注意深い観察をしながら治療を行い、そのような副作用が起こった場合は迅速かつ適切に対処いたします。
3) アフェレーシスに伴う副作用について
腕や鼠径部等の血管から血液を体外循環させますが、血管への穿刺に関しては十分に消毒を行い、これに習熟した医師が行います。まれに皮下出血を認めることはあります。また採血の緊張からめまいや吐き気、さらには血圧の低下もありますが、症状を観察しながら採取速度を調節することでそれらの出現を抑えます。
アフェレーシスでは血液が凝固しないよう抗凝固剤を使用しますが、これに含まれるクエン酸によって血中のカルシウム濃度が低下することがあります。そのために、初期症状として口唇、手指のしびれが出現することがあり、さらに進行すると嘔気、嘔吐、手指筋肉のツッパリが出てくることがあります。初期症状が認められた場合には、当該段階で採取・返血速度を遅くしたり、あるいはカルシウム濃度を是正する薬剤を投与することで症状の改善をします。
時に血小板減少がみられることもありますがすぐに回復するため、血小板輸血が必要になることはありません。
- 他の治療法の有無、内容、他の治療法の効果と副作用との比較
1) 他の治療法
外科的手術、抗がん剤、放射線の3つのがん標準治療があります。また最近は新たな抗体治療もあります。これらの治療法は、すでにがん治療として確立した治療方法です。これらの治療を行っている場合、あるいは行う予定がある場合には、可能な限り、その治療スケジュールに応じた最適の『GMP基準準拠アルファーガラクトシルセラミド』で刺激した樹状細胞の投与時期や投与間隔を決めていきます。 - 他の治療法の効果との比較
外科手術、放射線治療、化学療法これまでの標準治療は国内外で長年にわたり臨床研究及び臨床応用等が行われ、その効果については、腫瘍の縮小や延命効果に対する科学的医学的な根拠が示されております。
株式会社理研免疫再生医学の開発によるNKT細胞標的治療(RIKNKT®)は、現在、厚生労働省が定めた「再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)(平成25年法律85号)」に基づき適法に提供されています。 - 他の治療法の副作用との比較
標準治療の副作用の内容、程度、頻度などが明らかになっています。食欲不振、下痢、脱毛、皮膚障害、末梢神経障害、骨髄抑制など、ごく軽度なものから重篤なものまで多岐にわたります。当療法ではこのような副作用はほとんど認められません。 - 治療提供終了後の追跡調査
再生医療等の安全性の確保等に関する法律(平成25年法律85号)により、治療終了後の病状経過や疾病発生など、一定期間の追跡調査が定められています。治療後の副作用の有無と効果を追跡するため、NKT細胞標的治療(RIKNKT®)終了後から5年間、当クリニックより、お届けいただいたご連絡先に、追跡調査表をお送りしますのでご協力をお願いいたします。 - 拒否は自由です
この治療に同意した場合であっても、治療の開始前後、培養の採血の前後にかかわらず、いつでもその同意を撤回でき、治療を中止できます。それを理由にその後の治療に不利益を受けることはありません。ただし、細胞の培養開始後の撤回については、規定による細胞培養費用が請求されます。 - 個人情報の保護
当クリニックの個人情報取扱規定に基づき個人情報を保護します。患者様を特定し得る氏名などのプライバシーに関わる情報が、ご本人の同意なく、他に提供されたり公開されたりすることはありません。
名前などの個人情報は細胞培養委託先であるバイオアクセル株式会社京大桂ベンチャープラザ細胞培養加工施設等関連施設と「GMP基準準拠アルファーガラクトシルセラミド」の提供元で治療工程を管理する株式会社理研免疫再生医学と、情報共有することで細胞培養・保存取扱いなど細胞管理を厳重に行います。 - 実施に関わる費用
初診料:30,000円(税別)
感染症等検査費(初診時のみ):30,000円(税別)
治療費:3,145,000円(税別)
*同意撤回その他理由を問わず細胞培養が開始された後においてはそれまでに掛かった培養費用の請求が発生します。
*当院は自由診療(公的医療保険適用外)です。
- 健康被害の賠償
採血や治療に伴い、患者様に健康被害が発生したときは、その程度により、クリニックで対処可能であれば適切な処置を行い、対処が難しい場合は入院可能な病院へ紹介し治療を行います。過失による賠償が必要な健康被害と認定された場合、医師・医療施設責任賠償保険を介して賠償が行われます。 - 特許権、著作権、財産権、経済的利益の帰属
治療の結果として、治療に関する特許権や経済的利益が生じる場合がありますが、これらは提供された試料全体から得られる知見であるため、患者様個人が特許権・著作権、財産権、経済的利益を得られるものではありません。 - 質問の自由
当治療の提供、保存、研究等についての質問や苦情は、ソラリアクリニック医師にお尋ねください(午前11時から午後18時:日休診) - 認定再生医療等委員会について
ソラリアクリニック東京で提供するAlpha-Galactosylceramide刺激自己樹状細胞を用いたNKT細胞標的治療(RIKNKT®)は日本薬事法務学会再生医療等委員会にて審査を受けています。
日本薬事法務学会再生医療等委員会(認定番号:NB3140007)
連絡先 東京都中央区銀座8-18-11OGURAビル6F
電話番号:03-6264-3883 Mail:info@japal.org
責任者 医師 古賀祥嗣
電話番号:03-6665-6377 FAX: 03-6665-6378



